Bảng tuần hoàn hoá học
Bảng tuần hoàn hóa học - Chìa khóa chinh phục thế giới hóa học cùng Examon Bạn đang chìm đắm trong thế giới hóa học đầy màu sắc, đầy kỳ thú nhưng gặp khó khăn trong việc ghi nhớ Bảng tuần hoàn? Đừng lo lắng, Examon sẽ đồng hành cùng bạn!
Mục lục bài viết
Bảng tuần hoàn hóa học - một công cụ đầy quyền năng, ẩn chứa vô vàn bí mật về thế giới hóa học đầy mê hoặc. Giữa vô số nguyên tố cấu tạo nên vũ trụ, bảng tuần hoàn như một bản đồ chi tiết, giúp ta định vị và khám phá những quy luật vận hành tinh vi của tự nhiên.
Hôm nay, hãy cùng Examon dấn thân vào hành trình chinh phục bảng tuần hoàn, mở ra cánh cửa dẫn đến kho tàng tri thức hóa học vô bờ bến!

1. Bảng tuần hoàn hoá học là gì?
Bảng tuần hoàn hoá học có tên gọi đầy đủ là Bảng tuần hoàn các nguyên tố hoá học, còn được viết với tên Bảng tuần hoàn Mendeleev, là một phương pháp liệt kê các nguyên tố hoá học thành dạng bảng, dựa trên số hiệu nguyên tử (số proton trong hạt nhân), cấu hình electron và các tính chất hoá học tuần hoàn của chúng. Các nguyên tố được biểu diễn theo trật tự số hiệu nguyên tử tăng dần, thường liệt kê cùng với ký hiệu hoá học trong mỗi ô. Dạng tiêu chuẩn của bảng gồm các nguyên tố được sắp xếp thành 18 cột và 7 dòng, với hai dòng kép nằm riêng nằm bên dưới cùng.
Phần lớn sự hiểu biết hiện đại về các nguyên tố được phát triển từ công trình của Dmitri Mendeleev, một nhà hóa học người Nga. Ông đã công bố bảng tuần hoàn dễ nhận biết đầu tiên vào năm 1869. Bảng này sắp xếp các nguyên tố theo số nguyên tử tăng dần thành các hàng ("chu kỳ") trong đó các nguyên tố cùng cột ("nhóm") có chung các tính chất vật lý và hóa học một cách tuần hoàn. Bảng tuần hoàn tóm tắt các tính chất khác nhau của các nguyên tố, cho phép các nhà hóa học suy ra mối quan hệ giữa chúng và đưa ra dự đoán về các hợp chất và các nguyên tố mới tiềm năng. Nhờ vào nó, con người có thể dễ dàng hiểu về sự vận hành của các nguyên tố và các quy luật hoá học khác. So với thời điểm mới ra mắt, bảng tuần hoàn hoá học đã được bổ sung thêm một số nguyên tố mới.
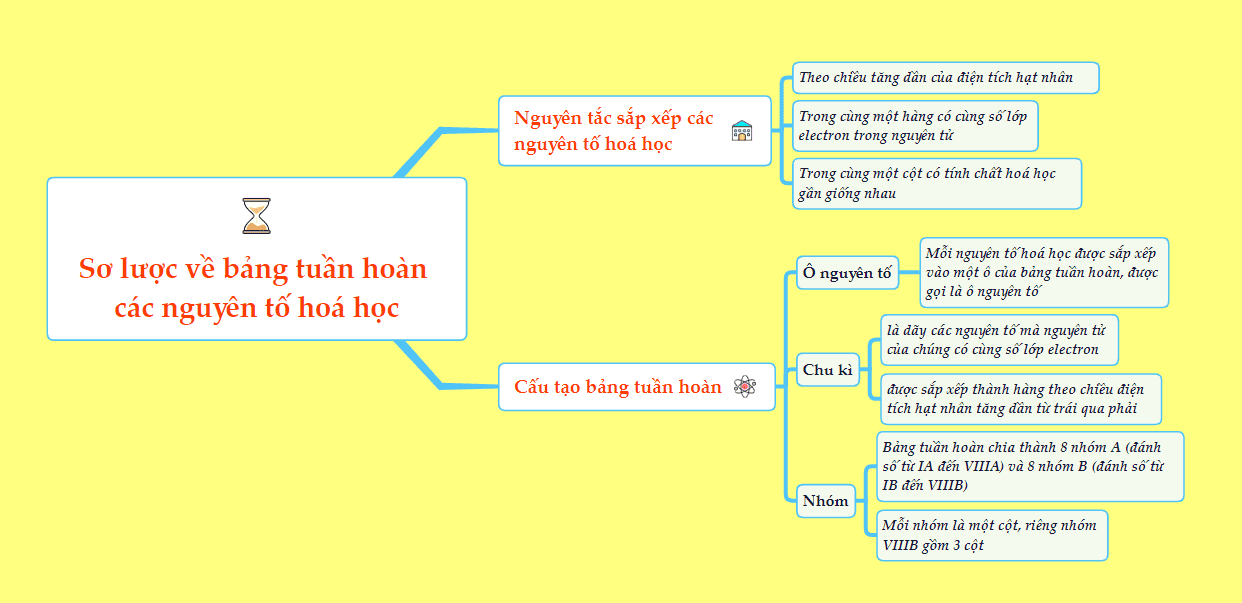
2. Cấu tạo của bảng tuần hoàn
2.1. Ô nguyên tố
- Ô nguyên tố cho biết: Số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối và nhiều đại lượng đặc trưng khác của nguyên tố đó.
- Cách xác định ô nguyên tố: Số thứ tự ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó.

Ví dụ: Số hiệu nguyên tử của Al là 13 cho biết: Nhôm ở ô số 13, điện tích hạt nhân nguyên tử nhôm là 13+, có 13 electron; 13 proton trong nguyên tử nhôm.
2.2. Chu kỳ
- Chu kỳ là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần.
- Cách xác định số thứ tự chu kỳ trong bảng tuần hoàn:
Số thứ tự của chu kỳ bằng số lớp electron trong nguyên tử.
Ví dụ:
Mg có cấu hình electron nguyên tử: \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2}\)
Vậy Mg thuộc chu kỳ 3 (do có 3 lớp electron).
Bảng tuần hoàn hóa học gồm có 7 chu kỳ, trong đó có các chu kỳ nhỏ là chu kỳ \(1,2,3\), các chu kỳ lớn là \(4,5,6,7\).
- Chu kỳ 1: Có 2 nguyên tố là He và H, có 1 lớp electron trong nguyên tử. Điện tích hạt nhân tăng từ H 1+ tới He 2+.
- Chu kỳ 2: 8 nguyên tố từ Li đến \(\mathrm{Ne}\), có 2 lớp electron trong nguyên tử. Điện tích hạt nhân tăng từ Li 3+ tới Ne là \(10+\).
- Chu kỳ 3: Gồm 8 nguyên tố từ nguyên tố \(\mathrm{Na}\) đến \(\mathrm{Ar}\), có 3 lớp electron trong nguyên tử và điện tích hạt nhân tăng từ \(\mathrm{Na} 11+\) đến nguyên tố Ar là \(18+\).
- Chu kỳ 4, chu kì 5: Với cả 2 chu kỳ, mỗi chu kỳ đều có 18 nguyên tố, bắt đầu là kim loại kiềm \(\mathrm{K}\) là \(19+\) và \(\mathrm{Rb}\) là \(37+\), kết thúc là một khí hiếm Xe là 54+ và Kr là \(36+\).
- Chu kỳ 6: Bắt đầu từ kim loại kiềm Cs là \(55+\) và kết thúc là khí hiếm Rn là 86+. Có 32 nguyên tố.
- Chu kỳ 7: Chưa được hoàn thành.
2.3. Nhóm nguyên tố
- Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được sắp xếp thành một cột.
- Có 2 loại nhóm nguyên tố là nhóm A và nhóm B. Trong đó: Nhóm A: Gồm các nguyên số s và p. Nhóm B: Gồm các nguyên tố d và f.
- Bảng tuần hoàn có 18 cột chia thành 8 nhóm A (đánh số từ IA đến VIIIA) và 8 nhóm B (đánh số từ IB đến VIIIB). Mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột.
- Cách xác định số thứ tự nhóm nguyên tố trong bảng tuần hoàn:
+ Nguyên tử các nguyên tố trong cùng một nhóm có số electron hóa trị bằng nhau và bằng số thứ tự của nhóm (trừ hai cột cuối của nhóm VIIIB).
+ Để xác định nhóm nguyên tố:
Bước 1: Viết cấu hình electron nguyên tử của nguyên tố.
Bước 2: Xác định số electron hóa trị
STT nhóm = số electron hóa trị (trừ II cột cuối nhóm VIIIB)
Bước 3: Xác định khối nguyên tố:
Nếu nguyên tố khối s hoặc khối p → thuộc nhóm A
Nếu nguyên tố khối d hoặc khối f → thuộc nhóm B.
Ví dụ:
\(+\mathrm{Na}(\mathrm{Z}=11):[\mathrm{Ne}] 3 \mathrm{~s}^{1}\) =>Na thuộc nhóm IA do có 1 electron hóa trị, nguyên tố s.
\(+\mathrm{Fe}(\mathrm{Z}=26):[\mathrm{Ar}] 3 \mathrm{~d}^{6} 4 \mathrm{~s}^{2}\)=> Fe thuộc nhóm VIIIB do có 8 electron hóa trị, nguyên tố d.
3. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn hoá học
Trong bảng tuần hoàn hóa học, các nguyên tố sẽ được sắp xếp dựa trên 3 nguyên tắc sau:
- Nguyên tắc 1: Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Nguyên tắc 2: Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
- Nguyên tắc 3: Các nguyên tố có cùng số electron hóa trị trong nguyên tử được sắp xếp thành một cột.
4. Ý nghĩa bảng tuần hoàn hoá học
2 ý nghĩa chính của bảng tuần hoàn các nguyên tố hóa học:
- Biết vị trí của nguyên tố ta có thể suy đoán cấu tạo nguyên tử và tính chất của nguyên tố.
Ví dụ:
Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm IA. Hãy cho biết cấu tạo nguyên tử, tính chất nguyên tố A và so sánh với các nguyên tố bên cạnh.
Hướng dẫn trả lời:
+ Nguyên tố A có số hiệu nguyên tử là 11, suy ra điện tích hạt nhân của nguyên tử A là 11+, nguyên tử A có 11 electron.
+ A ở chu kì 3, suy ra nguyên tử A có 3 lớp electron; nhóm IA suy ra lớp ngoài cùng có 1e.
+ Vì ở đầu chu kì 3 nên A là một kim loại mạnh, tính kim loại của A mạnh hơn tính kim loại của nguyên tố phía trên nó trong cùng nhóm (là Li có số hiệu nguyên tử là 3), mạnh hơn tính kim loại của nguyên tố sau nó trong cùng chu kì (là Mg có số hiệu là 12) nhưng yếu hơn nguyên tố đứng dưới nó trong cùng nhóm (là K có số hiệu nguyên tử là 19)
Nhận xét: Biết vị trí của nguyên tố trong bảng tuần hoàn có thể suy đoán cấu tạo nguyên tử và tính chất cơ bản của nguyên tố, so sánh tính kim loại hay phi kim của nguyên tố này với những nguyên tố lân cận.
- Biết cấu tạo nguyên tử của nguyên tố có thể suy đoán vị trí và tính chất nguyên tố đó.
Ví dụ:
Nguyên tố X có điện tích hạt nhân là 11+, 3 lớp electron, lớp ngoài cùng có 1 electron. Hãy cho biết vị trí của X trong bảng tuần hoàn và tính chất cơ bản của nó.
Hướng dẫn trả lời:
- Vì nguyên tử X có điện tích hạt nhân là 11+, 3 lớp electron và có 1e ở lớp ngoài cùng, suy ra nguyên tố X ở ô 11, chu kì 3, nhóm IA.
- Nguyên tố X là kim loại vì ở đầu chu kì.
Nhận xét: Biết cấu tạo nguyên tử của nguyên tố có thể suy đoán vị trí nguyên tố trong bảng tuần hoàn và tính chất hóa học cơ bản của nó.
5. Bảng tuần hoàn hoá học Mendeleev
5.1. Bảng nguyên tố hóa học lớp 8
Bước vào chương trình Hóa học lớp 8, Bộ giáo dục và đào tạo cho học sinh tiếp xúc với một số vấn đề liên quan đến bảng tuần hoàn. Điểu này giúp học sinh có thể làm quen được điều căn bản, hiêu được bản chất của vấn đề. Một số điều mà học sinh sẽ được tiếp cận là:
- Nguyên tử
- Nguyên tố hóa học

5.2. Bảng tuần hoàn hóa học lớp 9
Với Hóa 9, học sinh sẽ được cái nhìn khái quát về bảng tuần hoàn hóa học. Sơ lược 1 số kiến thức về bảng tuần hoàn hóa học, gồm có:
- Nguồn gốc
- Nguyên tắc sắp xếp các nguyên tố
- Cấu tạo
- Sự biến đổi tính chất các nguyên tố
- Ý nghĩa của bảng tuần hoàn

5.3. Bảng nguyên tố hóa học lớp 10
Sau khi đã được làm quen với bảng tuần hoàn các nguyên tố hóa học thì khi lên lớp 10, đòi hỏi học sinh phải nắm chắc kiến thức thật chắc. Trong Hóa học 10, bảng tuần hoàn hóa học chủ yếu chỉ đi sâu hơn về: Nguồn gốc về sự phát minh, nguyên tắc sắp xếp các nguyên tố, cấu tạo bảng tuần hoàn, bài luyện tập nâng cao, cơ bản.
6. Cách đọc bảng tuần hoàn hóa học
Để học sinh sử dụng bảng tuần hoàn một cách dễ dàng, hãy xem cách đọc bảng tuần hoàn hóa học dưới đây:
+ Số nguyên tử: Còn có tên gọi khác là số proton của nguyên tố hóa học. Đây là số proton tìm thấy trong hạt nhân của 1 nguyên tử. Là số điện tích hạt nhân. Số nguyên tử giúp xác định được duy nhất 1 nguyên tố hóa học.
+ Nguyên tử khối trung bình: Nguyên tử khối của các nguyên tố có đồng vị là số NTK trung bình của hỗn hợp các đồng vị, tính đến tỷ lệ phần trăm số nguyên tử tương ứng.
+ Độ âm điện: Là khả năng hút electron của nguyên tử khi tạo liên kết hóa học. Khi độ âm điện của nguyên tử nguyên tố càng lớn thì tính phi kim càng mạnh và ngược lại.
+ Cấu hình electron: Cho biết phân bố các electron trong lớp vỏ nguyên tử ở trạng thái năng lượng khác nhau.
+ Số oxi hóa: Số oxi hóa là số áp cho một hay nhóm nguyên tử. Nhờ có số oxi hóa mà chúng ta nhận biết được số electron trao đổi khi một chất bị oxi hóa hoặc bị khử.
+ Tên nguyên tố: Là một chất hóa học tinh khiết, gồm 1 kiểu nguyên tử, được phân biệt bởi số hiệu nguyên tử, là số lượng proton có trong hạt nhân.
+ Ký hiệu hóa học: Là tên viết tắt của 1 nguyên tố hóa học trong bảng tuẩn hoàn hóa học.
7. Cách nhớ bảng tuần hoàn các nguyên tố hoá học
7.1. Ghi nhớ bảng tuần hoàn hóa học bằng cách truyền thống
Nghiên cứu và thực hành bảng tuần hoàn: Mỗi ô trong bảng tuần hoàn sẽ hiển thị đầy đủ thông tin về tên, ký hiệu, số hiệu nguyên tử. Nếu bạn tập trung ghi nhớ 10 nguyên tố đầu tiên. Lúc này bạn sẽ tìm ra quy luật cho các nguyên tố còn lại. Nhận biết các thành phần của từng nguyên tố: Khi sử dụng bảng tuần hoàn hóa học, bạn đọc phải biết được số nguyên tử, nguyên tử khối trung bình, cấu hình electron, độ âm điện, số oxi hóa, tên nguyên tố, ký hiệu hóa học. Tất cả đều có trong ô nguyên tố của bảng tuần hoàn.
- Học vài nguyên tố mỗi ngày: Đây là một cách học được nhiều học sinh áp dụng. Đối với bảng tuần hoàn có rất nhiều nguyên tố khó nhớ và các thông số thì việc phân nhỏ ra để học nó giúp não ghi nhớ được một cách lâu dài.
- In và dán bảng tuần hoàn nguyên tố hóa học tại những nơi dễ thấy nhất Nhiều nghiên cứu cho rằng, việc tiếp xúc nhiều lần với một thứ gì đó sẽ khiến bạn ghi nhớ chúng một cách tự nhiên dễ hơn. Do đó hãy dán bảng tuần hoàn ở những nơi dễ quan sát hay có thể chia thành nhiều phần để học. Điều này thật sự có thể hiệu quả cao trong việc ghi nhớ.
- Làm thẻ ghi chú cho mỗi nguyên tố. Cách làm này giống như làm một tập flashcard.
7.2. Dùng phương pháp học để ghi nhớ
2.1. Theo dãy hoạt động hóa học của kim loại
Chắc hẳn bạn nào cũng nhớ một câu nói quen thuộc: "Khi nào cần may áo giáp sắt nhớ sang phố hỏi cửa hàng Á Phi Âu". Đây là câu nói để ghi nhớ 16 nguyên tố hóa học trong dãy hoạt động hóa học của kim loại. Dãy hoạt động hóa học của kim loại bao gồm: \(\mathrm{Na}, \mathrm{F}, \mathrm{Ca}, \mathrm{Mg}\), \(\mathrm{Al}, \mathrm{Zn}, \mathrm{Fe}, \mathrm{Ni}, \mathrm{Sn}, \mathrm{Pb}, \mathrm{H}, \mathrm{Cu}, \mathrm{Hg}, \mathrm{Ag}, \mathrm{Pt}, \mathrm{Au}\).
2.2. Theo 8 nhóm
Nhóm IA: Hai (H), Li (Li), Nào (Na), Không (K), Rót (Rb), Cà (Cs), Fê (Fr).
Nhóm IIA: Banh (Be), Miệng (Mg), Cá (Ca), Sấu (Sr), Bẻ (Ba), Răng (Ra).
Nhóm IIIA: Bố (B), Ai (Al), Gáy (Ga), Inh (In), Tai (Ti).
Nhóm IV: Chú (C), Sỉ (Si), Gọi em (Ge), Sang nhắm (Sn), Phở bò (Pb).
Nhóm V: Nhà (N), Phương (P), Ăn (As), Sống (Sb), Bí (Bi).
Nhóm VI: Ông (O), Say (S), Sỉn (Se), Té (Te), Pò (Po).
Nhóm VII: Phải (F), Chi (Cl), Bé (Br), Yêu (I), Anh (At).
Nhóm VIII: Hằng (He), Nga (Ne), Ăn (Ar), Khúc (Kr), Xương (Xe), Rồng (Rn).
2.3. Theo bài ca hóa trị
Việc ghi nhớ theo bài ca hóa trị cũng là một cách ghi nhớ bảng tuần hoàn hóa học. Các em học sinh có thế tham khảo bài ca hóa trị dưới đây:
*Bài ca hoá trị 1
Kali (K), Iot (I), Hidrô (H)
Natri (Na) với Bạc (Ag), Clo (Cl) một loài
Là hoá trị I hỡi ai
Nhớ ghi cho kỹ khỏi hoài phân vân
Magiê (Mg), Kẽm (Zn) với Thuỷ Ngân (Hg)
Oxi (O), Đồng (Cu), Thiếc(Sn) thêm phần Bari (Ba)
Cuối cùng thêm chú Canxi (Ca)
Hoá trị II nhớ có gì khó khăn
Bác Nhôm (Al) hoá trị III lần
In sâu trí nhớ khi cần có ngay
Cacbon (C), Silic (Si) này đây
Có hoá trị IV không ngày nào quên
Sắt (Fe) kia lắm lúc hay phiền
II, III lên xuống nhớ liền ngay thôi
Nitơ (N) rắc rối nhất đời
I, II, III, IV khi thời lên V
Lưu huỳnh (S) lắm lúc chơi khăm
Xuống II lên VI khi nằm thứ IV
Phot pho (P) nói đến không dư
Có ai hỏi đến thì ừ rằng V
Em ơi, cố gắng học chăm
Bài ca hoá trị suốt năm cần dùng.
*BÀI CA HÓA TRỊ NÂNG CAO
Hidro (H) cùng với liti (Li)
Natri (Na) cùng với kali (K) chẳng rời
Ngoài ra còn bạc (Ag) sáng ngời
Chỉ mang hoá trị I thôi chớ nhầm
Riêng đồng (Cu) cùng với thuỷ ngân (Hg)
Thường II ít I chớ phân vân gì
Đổi thay II , IV là chì (Pb)
Điển hình hoá trị của chì là II
Bao giờ cùng hoá trị II
Là ôxi (O) , kẽm(Zn) chẳng sai chút gì
Ngoài ra còn có canxi (Ca)
Magiê (Mg) cùng với bari (Ba) một nhà
Bo (B) , nhôm (Al) thì hóa trị III
Cácbon © silic (Si) thiếc (Sn) là IV thôi
Thế nhưng phải nói thêm lời
Hóa trị II vẫn là nơi đi về
Sắt (Fe) II toan tính bộn bề
Không bền nên dễ biến liền sắt III
Phốtpho III ít gặp mà
Photpho V chính người ta gặp nhiều
Nitơ (N) hoá trị bao nhiêu ?
I , II, III , IV phần nhiều tới V
Lưu huynh lắm lúc chơi khăm
Khi II lúc IV , VI tăng tột cùng
Clo Iot lung tung
II III V VII thường thì I thôi
Mangan rắc rối nhất đời
Đổi từ I đến VII thời mới yên
Hoá trị II dùng rất nhiều
Hoá trị VII cũng được yêu hay cần
Bài ca hoá trị thuộc lòng
Viết thông công thức đề phòng lãng quên
Học hành cố gắng cần chuyên
Siêng ôn chăm luyện tất nhiên nhớ nhiều
*BÀI CA KÍ HIỆU HOÁ HỌC
Ca là chú Can xi
Ba là cậu Bari họ hàng
Au tên gọi là Vàng
Ag là Bạc cùng làng với nhau
Viết Đồng C trước u sau
Pb mà đứng cùng nhau là Chì
Al đấy tên gì?
Gọi Nhôm bác sẽ cười khì mà xem
Cacbon vốn tính nhọ nhem
Kí hiệu C đó bạn đem nhóm lò
Oxy O đấy lò dò
Gặp nhau hai bạn cùng hò cháy to
Cl là chú Clo
Lưu huỳnh em nhớ viết cho S (ét sờ).
Zn là Kẽm khó gì
Na gọi Natri học hàng
Br thật rõ ràng
Brom “người ấy” cùng làng Gari (Ga)
Fe chẳng khó chi
Gọi tên là sắt em ghi ngay vào
Hg chẳng khó tí nào
Thuỷ ngân em đọc tự hào chẳng sai
…
Bài ca nhắc bạn xa gần
Học chăm để nhớ khi cần viết ra.
8. Lời kết
Học về các nguyên tố trong bảng tuần hoàn hóa học không chỉ giúp bạn học tốt môn Hóa mà còn mở ra cánh cửa đến với nhiều lĩnh vực khoa học khác. Để học tốt môn Hóa, việc đầu tiên bạn cần làm là hiểu cách hoạt động của bảng tuần hoàn.
Hãy bắt đầu bằng việc nắm rõ các nhóm nguyên tố, chu kỳ, vị trí của từng nguyên tố trong bảng. Sau đó, hãy khám phá mối quan hệ giữa các nguyên tố, tính chất hóa học và ứng dụng của chúng trong đời sống.
Để có thể ghi nhớ kiến thức về các nguyên tố trong bảng tuần hoàn hóa học một cách hiệu quả và lâu dài, các bạn hãy thử sử dụng phương pháp liên tưởng sáng tạo, hình ảnh biểu tượng, luyện tập thường xuyên... Nhờ đó, bạn có thể áp dụng kiến thức đã học vào thực tế hiệu quả, nâng cao kết quả học tập môn hóa học, và có hứng thú, yêu thích môn học này hơn nữa. Examon tin tưởng rằng bạn sẽ thành công!
Tuy nhiên, việc ghi nhớ kiến thức giúp học tốt môn Hoá thôi chưa đủ, bạn cần luyện tập thường xuyên để củng cố tri thức và rèn luyện kỹ năng giải đề. Vậy bạn đã bao giờ bạn tự hỏi tại sao việc luyện đề lại quan trọng đến vậy không?
Rất nhiều bạn đã mắc sai lầm nghiêm trọng khi luyện đề: Không phải mọi bộ đề đều giống nhau. Nhiều bạn vẫn thường tìm kiếm và làm những bộ đề cũ kỹ, lỗi thời trên mạng mà không biết rằng chúng có thể không phản ánh chính xác chương trình học hay xu hướng ra đề mới nhất. Điều này không chỉ khiến bạn mất thời gian mà còn có thể dẫn đến những hiểu lầm về năng lực thực sự của mình.
Luyện đề đúng cách là phương pháp để bạn có thể nhận diện các dạng bài tập thường gặp, nắm vững phương pháp giải quyết hiệu quả và từ đó, nâng cao kỹ năng giải đề của mình. Với hệ thống đề được cập nhật liên tục và chính xác, Examon sẽ giúp bạn:
• Nhận diện các dạng bài thi quan trọng.
• Luyện tập với các phương pháp làm bài tối ưu.
• Thành thạo kỹ năng giải đề, sẵn sàng cho mọi kỳ thi.
Dưới đây, Examon sẽ hướng dẫn bạn cách luyện đề hiệu quả với hệ thống đề của Examon:
Bước 1: Tạo và Đăng nhập tài khoản Đầu tiên, các bạn cần có một tài khoản Examon. Chỉ với vài thao tác đăng ký nhanh chóng, bạn đã sẵn sàng cho hành trình chinh phục kiến thức!
Bước 2: Tiếp theo, hãy chọn lớp học, môn học mà bạn muốn luyện và khu vực bạn đang sống để Examon cung cấp đề thi phù hợp nhất với bạn.
Bước 3: Lựa chọn đề thi và Bắt đầu luyện, Examon có hai chế độ: Luyện tập để bạn làm quen và Thi thử để kiểm tra năng lực. Hãy chọn một đề thi phù hợp và bắt đầu luyện!
Bước 4: Khi làm bài, hãy tập trung và nghiêm túc như thể bạn đang ở trong phòng thi thật sự. Đây là cơ hội để rèn luyện sự tự tin và kỹ năng giải quyết vấn đề của bạn.
Bước 5: Nhận điểm và Phân tích kết quả sau khi hoàn thành, bạn sẽ nhận được điểm số ngay lập tức cùng với lời giải chi tiết cho từng câu hỏi, giúp bạn hiểu rõ mình cần cải thiện ở đâu.

Tham khảo ngay bộ đề được biên soạn đặc biệt bám sát 99,9% đề tham khảo kỳ thi THPT năm 2024 của Examon ngay!