Bài tập đọc bảng tuần hoàn hoá học
Bạn đang lạc bước trong mê cung kiến thức hóa học? Bảng tuần hoàn - chìa khóa vàng mở ra cánh cửa chinh phục thế giới hóa học đang ở ngay trước mắt bạn! Đừng lo lắng! Dicamon sẽ đồng hành cùng bạn trên hành trình khám phá đầy thú vị này.
Mục lục bài viết
Với dạng bài tập giải mã cấu tạo của bảng tuần hoàn các nguyên tố hóa học thì để làm được dễ dàng và hiệu quả thì các bạn cần ghi nhớ nhanh chóng phương pháp đọc hiểu bảng tuần hoàn.
Từ đó xác định thông tin về các nguyên tố hóa học và tính chất của chúng. Đây là một thử thách không hề dễ. Vì vậy trong bài viết này Examon nhắc lại các kiến thức cần nhớ và đưa ra phương pháp giải, ví dụ mẫu và phần bài tập củng cố để các bạn thử sức kiến thức vừa lĩnh hội.

1. Giới thiệu chung
Năm 1869, nhà hóa học Mendeleev đã công bố bảng tuần hoàn các nguyên tố hóa học. Theo đó, các nguyên tố được sắp xếp theo thứ tự tăng dần khối lượng nguyên tử.
Bảng tuần hoàn các nguyên tố hóa học hiện đại ngày nay được xây dựng dựa trên cơ sở mối liên hệ giữa số hiệu nguyên tử và tính chất của các nguyên tố.
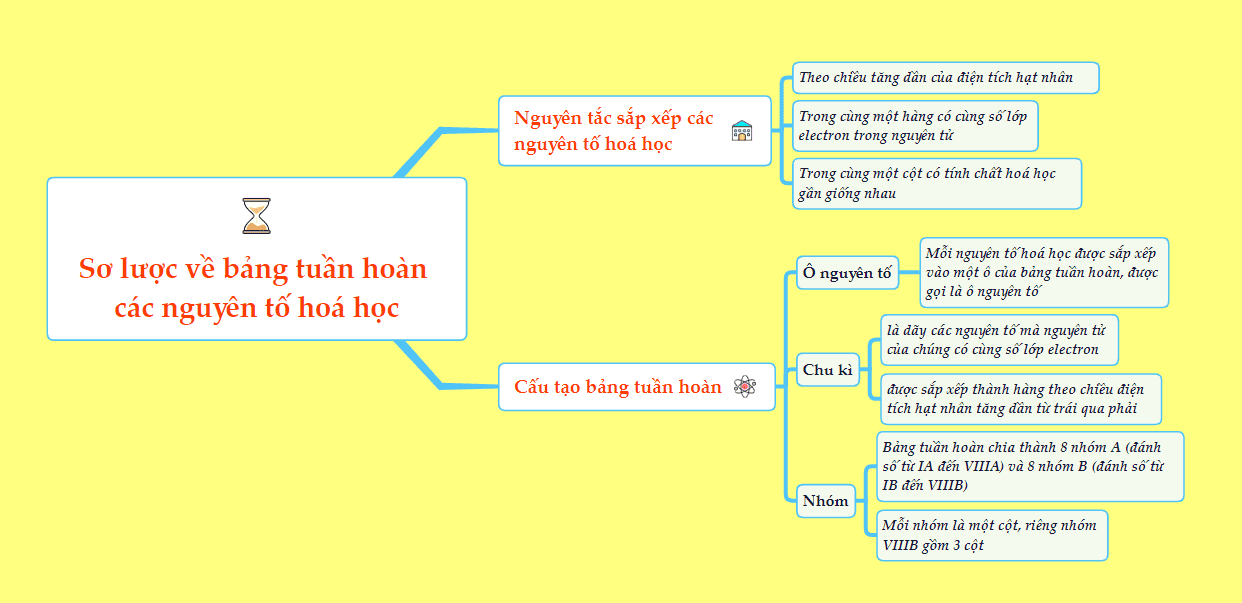
2. Kiến thức cần nhớ
2.1. Ô nguyên tố
- Ô nguyên tố cho biết: Số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối và nhiều đại lượng đặc trưng khác của nguyên tố đó.
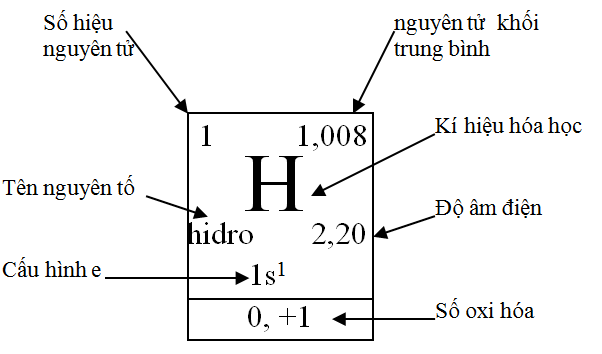
Số hiệu nguyên tử của H là 1 cho biết: Hidro ở ô số 1, điện tích hạt nhân nguyên tử hidro là 1+, chỉ có 1 electron trong nguyên tử hidro. Cấu hình electron nguyên tử hiđro là \(1s^1\).
2.2. Chu kỳ
- Chu kỳ là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần.
- Cách xác định số thứ tự chu kỳ trong bảng tuần hoàn:
Số thứ tự của chu kỳ bằng số lớp electron trong nguyên tử.
Ví dụ:
Mg có cấu hình electron nguyên tử: \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2}\)
Vậy Mg thuộc chu kỳ 3 (do có 3 lớp electron).
2.3. Nhóm nguyên tố
- Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được sắp xếp thành một cột.
- Có 2 loại nhóm nguyên tố là nhóm A và nhóm B. Trong đó: Nhóm A: Gồm các nguyên số s và p. Nhóm B: Gồm các nguyên tố d và f.
- Cách xác định số thứ tự nhóm nguyên tố trong bảng tuần hoàn:
+ Nguyên tử các nguyên tố trong cùng một nhóm có số electron hóa trị bằng nhau và bằng số thứ tự của nhóm (trừ hai cột cuối của nhóm VIIIB).
+ Để xác định nhóm nguyên tố:
Bước 1: Viết cấu hình electron nguyên tử của nguyên tố.
Bước 2: Xác định số electron hóa trị
STT nhóm = số electron hóa trị (trừ II cột cuối nhóm VIIIB)
Bước 3: Xác định khối nguyên tố:
Nếu nguyên tố khối s hoặc khối p → thuộc nhóm A
Nếu nguyên tố khối d hoặc khối f → thuộc nhóm B.
Minh hoạ:
\(+\mathrm{Na}(\mathrm{Z}=11):[\mathrm{Ne}] 3 \mathrm{~s}^{1}\) =>Na thuộc nhóm IA do có 1 electron hóa trị, nguyên tố s.
2.4. Cấu hình electron
Cấu hình electron nguyên tử biểu diễn được sự phân bố các electron trên các phân lớp tại các lớp khác nhau.
Cách viết cấu hình electron nguyên tử:
- Xác định được số electron của nguyên tử.
- Các electron này sẽ được phân bố theo thứ tự tăng dần các mức năng lượng \(A O\) và tuân theo nguyên lí Pau-li, nguyên lí vững bền và quy tắc Hund.
- Viết cấu hình electron phải theo thứ tự các phân lớp ở trong 1 lớp và theo thứ tự lần lượt của các lớp electron.
Chẳng hạn:

Dựa vào bảng tuần hoàn, ta xác định được:
- Nguyên tố natri (Z=11) có 11e. Vậy nên cấu hình electron là \(1\mathrm{s}^{2} 2 \mathrm{s}^{2} 2 \mathrm{p}^{6} 3\mathrm{s}^{1}\). Hoặc viết gọn: \([\mathrm{Ne}] 3 {s}^1\) (\([\mathrm{Ne}]\) là cấu hình e nguyên tử của nguyên tố Neon, là khí hiếm).
Lưu ý: Phân loại thành phần nguyên tố: các nguyên tố s, p, d, f là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s, p, d, f tương ứng. Cụ thể:
- Nhóm IA và IIA chứa nguyên tố \(\mathrm{s}\).
- Nhóm IIIA đến nhóm VIIIA (trừ He) chứa các nguyên tố \(\mathrm{p}\).
- Các nhóm từ IIIB đến IIB (theo chiều từ trái qua phải trong bàng tuần hoàn) chứa các nguyên tố d.
- Khối các nguyên tố f gồm các nguyên tố xếp ở hai hàng cuối của bảng tuần hoàn.
Ứng dụng: Dựa vào đặc điểm về cấu hình electron lớp ngoài cùng để dự đoán tính chất hóa học cơ bản của nguyên tố:
- Nguyên tố mà nguyên tử đủ 8 electron lớp ngoài cùng là khí hiếm (trừ He).
- Nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là nguyên tố kim loại.
- Nguyên tố mà nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tố phi kim.
2.5. Electron hoá trị
Electron hóa trị hay electron ngoài cùng là những electron ở các obitan của lớp ngoài cùng và phân lớp sát ngoài cùng chưa bão hòa, có thể tham gia vào việc hình thành liên kết hóa học.
- Nguyên tử \(\mathrm{Cl}\) có có cấu hình electron là \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{5}\)
\(\Rightarrow\) Cl thuộc nhóm \(\mathrm{A}\), lớp ngoài cùng có 7 electron nên số electron hóa trị bằng 7. Nguyên tử \(\mathrm{Cl}\) có 7 electron hóa trị.
*Cách tính số electron hóa trị:
+) Đối với các nguyên tố nhóm \(\mathrm{A}\) : dựa vào vị trí của nó trong bảng hệ thống tuần hoàn các nguyên tố hóa học.
- Các nguyên tố cùng nhóm có cùng số electron hóa trị chính là số thứ tự của nhóm. Hay nói cách khác số electron hóa trị là số electron lớp ngoài cùng
Ví dụ: Al có 3 electron hóa trị , N có 5 electron hóa trị (Trừ He có 2 electron hóa trị)
+) Đối với các nguyên tố nhóm \(\mathrm{B}\) (Nhóm kim loại chuyển tiếp): Trường hợp này hơi phức tạp hơn các nguyên tố nhóm \(\mathrm{A}\). Số electron hóa trị không hẳn là số electron lớp ngoài cùng mà ta còn phải tính cả số electron nằm ở phân lớp sát lớp ngoài cùng (phân lớp d).
3. Ví dụ minh hoạ
Nguyên tố calcium có Z = 20, đóng vai trò rất quan trọng đối với cơ thể, đặc biệt là xương và răng. Xác định vị trí của nguyên tố trên trong bảng tuần hoàn và cho biết chúng thuộc loại nguyên tố s, p hay d; là kim loại, phi kim hay khí hiếm.
Lời giải chi tiết:
Nguyên tố calcium \(Z\) có \(\left( C a \right )\) = 20 nên nguyên tử có 20 electron.
\(\Rightarrow\) Cấu hình electron nguyên tử Ca là \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 4 s^{2}\).
\(\Rightarrow\) Nguyên tử có 4 lớp electron và electron lớp ngoài cùng là 2 nên số electron hóa trị bằng 2.
\(\Rightarrow\) Nguyên tố calcium là kim loại, thuộc ô thứ 20, chu kì 4, nhóm IIA, nguyên tố s.
4. Bài tập tự luyện
Câu 1. Nguyên tố aluminium (Al) có số hiệu nguyên tử là 13. Al thuộc khối nguyên tố
A. s
B. p
C. d
D. f
Câu 2. Chọn cấu hình electron không đúng.
A. \(1 s^{2} 2 s^{2} 2 p^{5}\).
B. \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2}\).
C. \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{5}\).
D. \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{3} 4 s^{2}\).
Câu 3. Argon (Ar) có số hiệu nguyên tử là 18. Ar là nguyên tố
A. kim loại
B. phi kim
C. khí hiếm
D. kim loại hoặc phi kim
Câu 4. Nguyên tố Y ở chu kì 3 nhóm IVA. Cấu hình electron nguyên tử của Y là
A. \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{4}\)
B. \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{2}\)
C. \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6}\)
D. \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 3 d^{3} 4 s^{2}\)
6. Học tập hiệu quả cùng Examon
Examon đã tâm huyết tổng hợp đầy đủ mọi kiến thức về bảng tuần hoàn, từ phương pháp giải đến bài tập thực hành, giúp bạn dễ dàng ghi nhớ và học tập hiệu quả hơn. Hy vọng sau bài viết này, bạn đã nắm vững cấu tạo của bảng tuần hoàn, phương pháp đọc hiểu, cách nhận biết các nguyên tố hóa học và tính chất của chúng. Hãy đồng hành cùng Examon mỗi ngày để chinh phục những đỉnh cao mới trong học tập!
Đã bao giờ bạn tự hỏi tại sao việc luyện đề lại quan trọng đến vậy không? Rất nhiều bạn đã mắc sai lầm nghiêm trọng khi luyện đề: Không phải mọi bộ đề đều giống nhau.
Nhiều bạn vẫn thường tìm kiếm và làm những bộ đề cũ kỹ, lỗi thời trên mạng mà không biết rằng chúng có thể không phản ánh chính xác chương trình học hay xu hướng ra đề mới nhất. Điều này không chỉ khiến bạn mất thời gian mà còn có thể dẫn đến những hiểu lầm về năng lực thực sự của mình.
Luyện đề đúng cách là phương pháp để bạn có thể nhận diện các dạng bài tập thường gặp, nắm vững phương pháp giải quyết hiệu quả và từ đó, nâng cao kỹ năng giải đề của mình. Với hệ thống đề được cập nhật liên tục và chính xác, Examon sẽ giúp bạn:
- Nhận diện các dạng bài thi quan trọng.
- Luyện tập với các phương pháp làm bài tối ưu.
- Thành thạo kỹ năng giải đề, sẵn sàng cho mọi kỳ thi.
Dưới đây, Examon sẽ hướng dẫn bạn cách luyện đề hiệu quả với hệ thống đề của Examon:

- Bước 1: Tạo và Đăng nhập tài khoản Đầu tiên, các bạn cần có một tài khoản Examon. Chỉ với vài thao tác đăng ký nhanh chóng, bạn đã sẵn sàng cho hành trình chinh phục kiến thức!
- Bước 2: Tiếp theo, hãy chọn lớp học, môn học mà bạn muốn luyện và khu vực bạn đang sống để Examon cung cấp đề thi phù hợp nhất với bạn.
- Bước 3: Lựa chọn đề thi và Bắt đầu luyện, Examon có hai chế độ: Luyện tập để bạn làm quen và Thi thử để kiểm tra năng lực. Hãy chọn một đề thi phù hợp và bắt đầu luyện!
- Bước 4: Khi làm bài, hãy tập trung và nghiêm túc như thể bạn đang ở trong phòng thi thật sự. Đây là cơ hội để rèn luyện sự tự tin và kỹ năng giải quyết vấn đề của bạn.
- Bước 5: Nhận điểm và Phân tích kết quả sau khi hoàn thành, bạn sẽ nhận được điểm số ngay lập tức cùng với lời giải chi tiết cho từng câu hỏi, giúp bạn hiểu rõ mình cần cải thiện ở đâu.
Tham khảo ngay bộ đề được biên soạn đặc biệt bám sát 99.9% đề tham khảo kỳ thi THPT năm 2024 của Examon ngay!