6 dạng bài tập bảng tuần hoàn hóa học
Nếu bạn chọn môn hóa là môn đồng hành cùng với bản thân trong kì thi đại học. Vậy thì đừng bỏ qua 6 dạng bài tập bảng tuần hoàn hóa học có thể xuất hiện trong đề thi THPTQG dưới đây nha.
Mục lục bài viết
Nếu bạn vừa mới học bảng tuần hoàn hóa học thì các dạng bài tập dưới đây sẽ giúp bạn luyện tập, còn nếu bạn đã lỡ quên thì cùng Examon tìm hiểu những bài tập dưới đây để củng cố lại kiến thức của mình nhé. Chần chờ gì mà không cầm bút lên học hóa học ngay thôi.

1. Dạng 1: Mối liên hệ giữa vị trí với cấu tạo nguyên tử, nguyên tố, tính chất hợp chất
1.1 Phương pháp giải
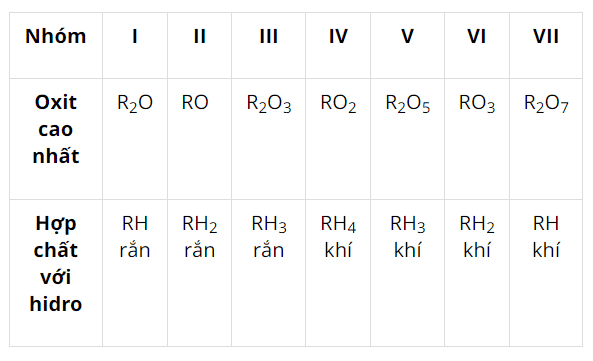
- Số thứ tự ô nguyên tố = tổng số e của nguyên tử.
- Số thứ tự chu kì = số lớp e.
- Số thứ tự nhóm:
+ Nếu cấu hình e lớp ngoài cùng có dạng \(\mathbf{n s}^{\mathbf{a}} \mathbf{n p}^{\mathbf{b}}(a=\) \(1 \rightarrow 2\) và \(b=0 \rightarrow 6)\) : Nguyên tố thuộc nhóm \((a+b) A\).
+ Nếu cấu hình e kết thúc ở dạng (n - 1) \(\mathbf{d}^{\mathrm{x}} \mathbf{n s}^{\mathrm{y}}(\mathrm{x}=\) \(1 \rightarrow 10 ; y=1 \rightarrow 2\) ): Nguyên tố thuộc nhóm \(B\) :
*Nhóm \((x+y) B\) nếu \(3 \leq(x+y) \leq 7\).
* Nhóm VIIIB nếu \(8 \leq(x+y) \leq 10\).
* Nhóm \((x+y-10) B\) nếu \(10\lt (x+y)\).
1.2. Ví dụ 1: các nguyên tố có cùng chu kỳ
Ví dụ 1: Cho nguyên tử các nguyên tố \(X_{1}, X_{2}, X_{3}, X_{4}, X_{5}, X_{6}\) lần lượt có cấu hình electron như sau:
\[\begin{array}{l}X_{1}: 1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} \\X_{2}: 1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 4 s^{1} \\X_{3}: 1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 4 s^{2} \\X_{4}: 1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{5} \\X_{5}: 1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 3 d^{6} 4 s^{2} \\X_{6}: 1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{4}\end{array}\]Các nguyên tố cùng một chu kì là:
A. \(X_{1}, X_{3}, X_{6}\)
B. \(X_{2}, X_{3}, X_{5}\)
C. \(X_{1}, X_{2}, X_{6}\)
D. \(X_{3}, X_{4}\)
1.3. Đáp án và lời giải ví dụ 1
Lời giải:
Các nguyên tố cùng một chu kì thì có cùng số lớp electron
\(\Rightarrow\) Đáp án B
1.4. Ví dụ 2: Tổng số hạt mang điện trong R
Ví dụ 3: Nguyên tử \(R\) tạo được Cation \(R^{+}\). Cấu hình e của \(R^{+}\)ở trạng thái cơ bản là \(3 p^{6}\). Tổng số hạt mang điện trong \(R\) là.
A. \(18 \quad\)
B. 22
C. 38
D. 19
1.5. Đáp án và lời giải ví dụ 2
Lời giải:
Cấu hình của \(\mathrm{R}^{+}\)là \(3 p^{6}\)
\(\Rightarrow\) của \(R\) sẽ là \(3 p^{6} 4 s^{1}\)
\(\Rightarrow R\) có cấu hình đầy đủ là \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 4 s^{1}\)
\(\Rightarrow\) Tổng hạt mang điện trong \(R\) là \((p+e)=38\)
Đáp án C
2. Dạng 2: So sánh tính chất các nguyên tố lân cận và hợp chất oxit, hidroxit của chúng
2.1. Phương pháp giải
Những đại lượng và tính chất biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Bán kính nguyên tử
+ Năng lượng ion hóa thứ nhất
+ Độ âm điện
+ Tính kim loại, tính phi kim
+ Tính axit - bazơ của oxit và hiđroxit
+ Hóa trị cao nhất của nguyên tố với oxi và hóa trị của nguyên tố phi kim với hiđro
2.2. Ví dụ 1: Sắp xếp các nguyên tố theo chiều tăng dần tính phi kim.
Ví dụ 1: Cho các nguyên tố \(O, C, N, F, B, B e\), Li. Thứ tự sắp xếp các nguyên tố theo chiều tăng dần tính phi kim là:
A. \(O, C, N, F, B, B e, L i\)
B. Li, Be, B, C, N, O, F
C. Li, Be, B, F, N, C, O
D. Li, Be, B, N, C, O, F
2.3. Đáp án và lời giải ví dụ 1
Lời giải:
Trong một chu kì theo chiều tăng của điện tích hạt nhân, tính phi kim của các nguyên tố tăng dần
\(\Rightarrow\) Đáp án B
2.4. Ví dụ 2: Sắp xếp các oxit theo chiều giảm dần tính bazơ
Ví dụ 2: Sắp xếp các oxit \(\mathrm{Al}_{2} \mathrm{O}_{3} ; \mathrm{Na}_{2} \mathrm{O} ; \mathrm{MgO} ; \mathrm{SiO}_{2} ; \mathrm{SO}_{3} ; \mathrm{P}_{2} \mathrm{O}_{5} ; \mathrm{Cl}_{2} \mathrm{O}_{7}\) theo chiều giám dần tính bazơ là:
A. \(\mathrm{Al}_{2} \mathrm{O}_{3} ; \mathrm{Na}_{2} \mathrm{O} ; \mathrm{MgO} ; \mathrm{SiO}_{2} ; \mathrm{SO}_{3} ; \mathrm{P}_{2} \mathrm{O}_{5} ; \mathrm{Cl}_{2} \mathrm{O}_{7}\)
B. \(\mathrm{SiO}_{2} ; \mathrm{SO}_{3} ; \mathrm{P}_{2} \mathrm{O}_{5} ; \mathrm{Cl}_{2} \mathrm{O}_{7} ; \mathrm{Al}_{2} \mathrm{O}_{3} ; \mathrm{Na}_{2} \mathrm{O} ; \mathrm{MgO}\)
C. \(\mathrm{Na}_{2} \mathrm{O} ; \mathrm{MgO} ; \mathrm{Al}_{2} \mathrm{O}_{3} ; \mathrm{SiO}_{2} ; \mathrm{P}_{2} \mathrm{O}_{5} ; \mathrm{SO}_{3} ; \mathrm{Cl}_{2} \mathrm{O}_{7}\)
D. \(\mathrm{SiO}_{2} ; \mathrm{P}_{2} \mathrm{O}_{5} ; \mathrm{SO}_{3} ; \mathrm{Cl}_{2} \mathrm{O}_{7} ; \mathrm{Na}_{2} \mathrm{O} ; \mathrm{MgO} ; \mathrm{Al}_{2} \mathrm{O}_{3}\)
2.5. Đáp án và lời giải ví dụ 2
Lời giải:
Trong một chu kì, theo chiều tăng dần điện tích hạt nhân tính bazơ của oxit tương ứng giảm dần.
Đáp án C
Bộ đề ôn cấp tốc 30 ngày cùng Examon

3.Dạng 3: Xác định 2 nguyên tố thuộc nhóm A liên tiếp
3.1. Phương pháp giải
Phương pháp giải:
Giả sử \(Z_{A}\lt Z_{B}\)
+ Nếu \(A\) và \(B\) thuộc cùng 1 chu kỳ thì: \(Z_{A}-Z_{B}=\mathbf{1}\).
+ Nếu A và B không biết có thuộc cùng 1 chu kỳ hay không thì phải dựa vào \(=Z / 2\) và \(Z_{A} \ll\lt Z_{B}\).
3.2. Ví dụ 1: Nguyên tố A,B là nguyên tố nào
Câu 1: A, B là 2 nguyên tố thuộc cùng 1 phân nhóm và thuộc 2 chu kì liên tiếp trong \(\mathrm{BTH}\). Tổng số proton trong hạt nhân 2 nguyên tử là \(30 . \mathrm{A}, \mathrm{B}\) là nguyên tố nào sau đây?
A. Li và Na
B. Na và K
C. \(\mathrm{Mg}\) và Ca
D. Be và \(M g\)
3.3. Đáp án và lời giải ví dụ 1
Lời giải:
Gọi số hiệu nguyên tử của nguyên tố \(A\) và \(B\) lần lượt là \(Z_{A}, Z_{B}\).
Tổng số proton trong hạt nhân 2 nguyên tử là \(30 \rightarrow \mathrm{Z}_{\mathrm{B}}+\mathrm{Z}_{\mathrm{A}}=30\) (1)
A, \(B\) là 2 nguyên tố thuộc cùng 1 phân nhóm và thuộc 2 chu kì liên tiếp trong BTH
TH1: A và B cách nhau 8 nguyên tố
\(\rightarrow \mathrm{Z}_{B}-\mathrm{Z}_{\mathrm{A}}=8\) (2)
Từ \((1)\) và \((2) \rightarrow Z_{B}=19 ; Z_{A}=11\)
\(Z_{B}=19 \rightarrow\) cấu hình electron: \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 4 s^{1}\)
\(\rightarrow\) nguyên tố \(B\) thuộc ô số 19, chu kì 4, nhóm IA. (K)\(\mathrm{Z}_{\mathrm{A}}=11 \rightarrow\) cấu hình electron: \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{1}\)
\(\rightarrow\) nguyên tố \(B\) thuộc ô số 11 , chu kì 3, nhóm IA (Na)\(\rightarrow\) Thỏa mãn
\(\rightarrow\) Chọn B
Với trắc nghiệm, chọn được đáp án không cần thiết phải xét tiếp TH \(2,3\).
TH2: A và B cách nhau 18 nguyên tố.
\(\rightarrow \mathrm{Z}_{\mathrm{B}}-\mathrm{Z}_{\mathrm{A}}=18\) (3)
Từ (1) và \((3) \rightarrow Z_{B}=24 ; Z_{A}=6\)
\(Z_{B}=24 \rightarrow\) cấu hình electron: \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 3 d^{4} 4 s^{2}\)\(\rightarrow\) nguyên tố B thuộc ô số 24 , chu kì 4, nhóm VIB
.\(Z_{A}=6 \rightarrow\) cấu hình electron: \(1 s^{2} 2 s^{2} 2 p^{2}\)\(\rightarrow\) nguyên tố \(A\) thuộc ô số 6 , chu kì 2 , nhóm IVA\(\rightarrow A\) và \(B\) không cùng thuộc một phân nhóm và hai chu kì liên tiếp \(\rightarrow\) loại
TH3: A và B cách nhau 18 nguyên tố
\(\rightarrow \mathrm{Z}_{\mathrm{B}}-\mathrm{Z}_{\mathrm{A}}=32\) (4)
Từ (1) và (4) \(\rightarrow Z_{B}=31 ; Z_{A}=-1\)\(\rightarrow\) loai
3.4. Ví dụ 2: Tìm hai kim loại X,Y
Câu 2: Cho 1,2 gam hỗn hợp gồm hai kim loại \(X\) và \(Y\) ở 2 chu kỳ liên tiếp thuộc nhóm IA tác dụng hết với \(\mathrm{H}_{2} \mathrm{O}\) (dư), thoát ra 1,344 lít khí \(\mathrm{H}_{2}\) (đktc). Hai kim loại X, Y lần lượt là
A. \(\mathrm{Na}, \mathrm{K}\)
B. Li, \(\mathrm{Na}\)
C. \(\mathrm{K}, \mathrm{Ca}\)
D. \(\mathrm{Na}\),\(\mathrm{Mg}\)
3.5. Đáp án và lời giải ví dụ 2
Hướng dẫn giải:
\[\mathrm{n}_{\mathrm{H}_{2}}=\frac{1,344}{22,4}=0,06 \mathrm{~mol}\]Đặt X và Y tướng ứng với kim loại \(\overline{\mathrm{R}}\). Ta có phương trình:
\[\begin{array}{l}2 \overline{\mathrm{R}}+2 \mathrm{H}_{2} \mathrm{O}-\gt 2 \overline{\mathrm{R}} \mathrm{OH}+\mathrm{H}_{2} \\0,12 \mathrm{~mol} \quad\lt -0,06 \mathrm{~mol} \\\rightarrow \mathrm{M} \overline{\mathrm{R}}=\frac{1,2}{0,12}=10(\mathrm{~g} / \mathrm{mol})\end{array}\]Giả sử \(M_{X}\lt M_{Y} \rightarrow M_{Z}\lt M \bar{R}, M_{Y}\)
\(\rightarrow\) Li \((M=7)\) và \(\mathrm{Na}(\mathrm{M}=23)\)
-> Chọn B
4. Dạng 4: Xác định hai nguyên tố thuộc cùng 1 nhóm A
4.1. Phương pháp giải
Phương pháp giảiTổng số hiệu nguyên tử \(4\lt Z_{T}\lt 32\) thì \(A, B\) sẽ thuộc các chu kỳ nhỏ hay \(Z_{A}-Z_{B}=8\).
- Nếu \(Z_{T}\gt 32\) thì ta phải xét cả 3 trường hợp:
+ A là \(\mathrm{H}\).
+ A và \(\mathrm{B}\) cách nhau 8 đơn vị.
+ \(\mathrm{A}\) và \(\mathrm{B}\) cách nhau 18 đơn vị.
4.2. Ví dụ 1: Cấu hình e của nguyên tố X
Ví dụ 1: \(X\) và Y là hai nguyên tố trong cùng một nhóm \(\mathrm{A}\) và ở hai chu kì liên tiếp của bảng tuần hoàn. Tổng số proton trong hạt nhân của hai nguyên tử \(X\) và \(Y\) bằng 30. Cấu hình electron của \(X\) là (biết \(M_{X}\lt\) \(\left.\mathrm{M}_{\mathrm{Y}}\right)\)
A. \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 4 s^{1}\)
B. \(1 s^{2} 2 s^{2} 2 p^{2}\)
C. \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{1}\)
D. \([A r] 3 d^{5} 4 s^{1}\)
4.3. Đáp án và lời giải ví dụ 1
Lời giải:
Vì \(X\) và \(Y\) thuộc cùng một nhóm \(A\) và ở chu kì liên tiếp nên ta có:
\[\left[\begin{array} { l } { \{ \begin{array} { l } { Z _ { X } + Z _ { Y } = 3 0 } \\{ Z _ { Y } - Z _ { X } = 8 }\end{array} } \\{ \{ \begin{array} { l } { Z _ { X } + Z _ { Y } = 3 0 } \\{ Z _ { Y } - Z _ { X } = 1 8 }\end{array} }\end{array} \Leftrightarrow \left[\begin{array}{l}\left\{\begin{array}{l}Z_{X}=11(\mathrm{Na}) \\Z_{Y}=19(K)\end{array}\right. \\\left\{\begin{array}{l}Z_{X}=6(C) \\Z_{Y}=24(\mathrm{Cr})\end{array}\right.\end{array}\right.\right.\]\(X\) và \(Y\) là hai nguyên tố trong cùng một nhóm \(A \Rightarrow X\) là Na và \(Y\) là \(K\)Khi đó cấu hình electron là của \(\mathrm{Na}\) là \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{1}\)
=> Đáp án C
4.4. Ví dụ 2: Tìm hai kim loại
Ví dụ 2: Cho 24,95 gam một hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp và đều thuộc nhóm IIA của bảng tuần hoàn tác dụng với axit \(\mathrm{H}_{2} \mathrm{SO}_{4}\) loãng thu được 4,48 lít khí \(\mathrm{H}_{2}\) (đktc). Hai kim loai đó là
A. Ca và \(\mathrm{Sr}\)
B. Sr và Ba
C. Be và Ca
D. Ca và \(B a\)
4.5. Đáp án và lời giải ví dụ 2
Lời giải:
Gọi công thức chung của hai kim loại thuộc nhóm IIA là \(\overline{\mathrm{M}}\)Có phản ứng: \(\overline{\mathrm{M}}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \overline{\mathrm{M}}_{2} \mathrm{SO}_{4}+\mathrm{H}_{2}\)
\[\Rightarrow \mathrm{n}_{\mathrm{M}}=\mathrm{n}_{\mathrm{H}_{2}}=0,2 \Rightarrow \overline{\mathrm{M}}=\frac{24,95}{0,2}=124,75\]Do đó hỗn hợp cần có 1 kim loại có \(M\) < 124,75 và 1 kim loại có khối lượng mol lớn hớn 124,75.
Mà hai kim loại trong hỗn hợp ở hai chu kì liên tiếp và thuộc nhóm IIA.
Nên hai kim loại đó là \(S r\) và \(B a\)
\(\Rightarrow\) Đáp án B
5. Dạng 5: Xác định nguyên tố dựa vào vị trí và tính theo phương trình hóa học
5.1. Ví dụ 1: Tìm nguyên tố M
Ví dụ 1: Cho 0,64 gam hỗn hợp gồm kim loại \(M\) và oxit của nó \(\mathrm{MO}\), có số mol bằng nhau, tác dụng hết với \(\mathrm{H}_{2} \mathrm{SO}_{4}\) loãng. Thể tích khí \(\mathrm{H}_{2}\) (đktc) thu được là 0,224 lít. Cho biết \(M\) thuộc nhóm IIA. Xác định M là nguyên tố nào sau đây?
A. \(\mathrm{Mg}\)
B. Ca
C. \(\mathrm{Sr}\)
D. \(\mathrm{Ba}\)
5.2. Đáp án và lời giải ví dụ 1
Lời giải:
Các phản ứng:
\[\left\{\begin{array}{l}\mathrm{M}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{MSO}_{4}+\mathrm{H}_{2} \\\mathrm{MO}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{MSO}_{4}+\mathrm{H}_{2} \mathrm{O}\end{array}\right.\]\[\begin{array}{l}\text { Vì } \mathrm{n}_{\mathrm{M}}=\mathrm{n}_{\mathrm{MO}} \Rightarrow \mathrm{n}_{\mathrm{MO}}=\mathrm{n}_{\mathrm{M}}=\mathrm{n}_{\mathrm{H}_{2}}=0,01 \\\Rightarrow \mathrm{m}_{\mathrm{M}}+\mathrm{m}_{\mathrm{MO}}=0,01(2 \mathrm{M}+16)=0,64 \\\Leftrightarrow M=24 \text { là } \mathrm{Mg}\end{array}\]\(\Rightarrow\) Đáp án \(A\)
5.3. Tìm kim loại M
Ví dụ 2: M là kim loại thuộc nhóm IIA. Hòa tan hết 10,8 gam hỗn hợp gồm kim loại \(M\) và muối cacbonat của nó trong dung dịch \(\mathrm{HCl}\), thu được 4,48 lít hỗn hợp khí A (đktc). Tỉ khối của A so với khí hiđro là 11,5 . M là:
A. Be
B. Ca
C. Ba
D. \(M g\)
5.4. Đáp án và lời giải ví dụ 2
Lời giải:
Các phản ứng:
\[\left\{\begin{array}{l}\mathrm{M}+2 \mathrm{HCl} \rightarrow \mathrm{MCl}_{2}+\mathrm{H}_{2} \\\mathrm{MCO}_{3}+2 \mathrm{HCl} \rightarrow \mathrm{MCl}_{2}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O}\end{array}\right.\]Do đó hỗn hợp khí \(\mathrm{A}\) thu được gồm \(\mathrm{H}_{2}\) và \(\mathrm{CO}_{2}\).
\[\begin{array}{l}\text { Gọi: }\left\{\begin{array} { l } { n _ { \mathrm { H } _ { 2 } } = \mathrm { a } } \\{ \mathrm { n } _ { \mathrm { CO } _ { 2 } } = \mathrm { b } }\end{array} \text { có } \left\{\begin{array} { c } { \mathrm { a } + \mathrm { b } = 0 , 2 } \\{ \frac { 2 \mathrm { a } + 4 4 \mathrm { b } } { 0 , 2 } = 1 1 , 5 . 2 }\end{array} \Leftrightarrow \left\{\begin{array}{l}\mathrm{a}=0,1 \\\mathrm{~b}=0,1\end{array}\right.\right.\right. \\\Rightarrow \mathrm{m}_{\mathrm{M}}+\mathrm{m}_{\mathrm{MCO}_{3}}=0,1(2 \mathrm{M}+60)=10,8 \\\Leftrightarrow \mathrm{M}=24 \text { là } \mathrm{Mg}\end{array}\]=> Đáp án D
6. Dạng 6: Xác định tên nguyên tố dựa vào công thức oxit cao nhất và công thức hợp chất khí với hidro
6.1. Phương pháp giải
Tổng Hóa trị trong hợp chất khí với hidro (nếu có) và hóa trị trong oxit cao nhất của một nguyên tố bằng 8.
6.2. Ví dụ 1: Phân tử khối của muối tạo ra
Ví dụ 1: Nguyên tố R là một phi kim, tỉ lệ phần trăm khối lượng của \(R\) trong hợp chất khí với hidro bằng 0,5955. Cho 4,05 gam một kim loại \(M\) chưa rõ hóa trị tác dụng hết với đơn chất R thì được 40,05 gam muối. Phân tử khối của muối tac ra là
A. 267
B. 169
C. 89
D. 107
6.3. Đáp án và lời giải ví dụ 1:
* Xác định nguyên tố phi kim R:
+Nếu hóa trị của \(R\) trong oxit cao nhất là chẵn thì ta có công thức của oxit cao nhất là \(R O_{n}\).
Khi đó công thức của hợp chất khí với hidro của \(\mathrm{R}\) là \(\mathrm{RH}_{8-2 n}\).
Theo giả thiết đề bài ta có:
\[\begin{array}{l}\frac{\frac{R}{R+16}}{\frac{R}{R+8-2 n}}=0,5955 \Leftrightarrow \frac{R+8-2 n}{R+16 n}=0,5955 \\\Leftrightarrow 0,4045 R+8=11,528 n\end{array}\]
Do đó trường hợp này có kết quả thỏa mãn.+) Nếu hóa trị của \(R\) trong oxit cao nhất là lẻ thì ta có công thức oxit cao nhất là \(\mathrm{R}_{2} \mathrm{O}_{n}\).
Khi đó công thức của hợp chất khí với hidro của \(R\) là \(\mathrm{RH}_{8-n}\).
Theo giả thiết đề bài ta có:
\[\begin{array}{l}\frac{\frac{2 R}{2 R+16 n}}{\frac{R}{R+8-n}}=0,5955 \Leftrightarrow \frac{2(R+8-n)}{2 R+16 n}=0,5955 \\\Leftrightarrow 0,809 R+16=11,528 n\end{array}\]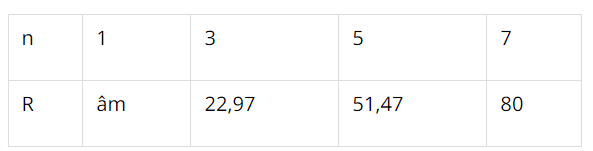
Do đó có \(n=7\) và \(R=80\) thóa mãn.
Suy ra R là Br.
* Xác định kim loại M.
Vì Br trong hợp chất muối với kim loại có hóa trị I
Nên gọi công thức của muối thu được là \(\mathrm{MBr}_{\mathrm{x}}\) với x là hóa trị của \(M\). Theo định luật bảo toàn khối lượng ta có:
\[\begin{array}{l}m_{\mathrm{Br}}=m_{\text {muб́i }}-m_{M}=40,05-4,05=36 \text { (gam) } \\\Rightarrow n_{\mathrm{Br}}=\frac{36}{80}=0,45 \Rightarrow n_{M}=\frac{n_{\mathrm{B}}}{x}=\frac{0,45}{x} \\\text { Mà } n_{M}=\frac{m}{M}=\frac{4,05}{M} \text { nên } \frac{0,45}{x}=\frac{4,05}{M} \\\Leftrightarrow M=9 x \Rightarrow\left\{\begin{array}{l}x=3 \\M=27\end{array}\right. \text { là Al. }\end{array}\]Do đó muối thu được là \(\mathrm{AlBr}_{3}\).
Vậy phân tử khối của muối tạo ra là \(27+80.3=267\)\(\Rightarrow\) Đáp án \(A\)
7. Lời kết
Nếu bạn bỏ cuộc bây giờ thì chính bạn chính là người tước đi cơ hội thành công của chính mình. Học hóa có thể khó nhưng Examon tin rằng không gì có thể làm khó được ý chí phấn đấu của bất kỳ ai. Examon hy vọng qua 6 dạng bài tập về bảng tuần hoàn hóa học ở trên sẽ giúp bạn học học tốt môn hóa hơn. Ghi nhớ và vận dụng làm bài tập là cách học để nhớ lâu hơn. Chúc bạn học tốt!
8. Cách học tốt môn hóa
Đã bao giờ bạn tự hỏi tại sao việc luyện đề lại quan trọng đến vậy không? Rất nhiều bạn đã mắc sai lầm nghiêm trọng khi luyện đề: Không phải mọi bộ đề đều giống nhau.
Nhiều bạn vẫn thường tìm kiếm và làm những bộ đề cũ kỹ, lỗi thời trên mạng mà không biết rằng chúng có thể không phản ánh chính xác chương trình học hay xu hướng ra đề mới nhất. Điều này không chỉ khiến bạn mất thời gian mà còn có thể dẫn đến những hiểu lầm về năng lực thực sự của mình.
Luyện đề đúng cách là phương pháp để bạn có thể nhận diện các dạng bài tập thường gặp, nắm vững phương pháp giải quyết hiệu quả và từ đó, nâng cao kỹ năng giải đề của mình. Với hệ thống đề được cập nhật liên tục và chính xác, Examon sẽ giúp bạn:
- Nhận diện các dạng bài thi quan trọng.
- Luyện tập với các phương pháp làm bài tối ưu.
- Thành thạo kỹ năng giải đề, sẵn sàng cho mọi kỳ thi.
Dưới đây, Examon sẽ hướng dẫn bạn cách luyện đề hiệu quả với hệ thống đề của Examon:
- Bước 1: Tạo và Đăng nhập tài khoản Đầu tiên, các bạn cần có một tài khoản Examon. Chỉ với vài thao tác đăng ký nhanh chóng, bạn đã sẵn sàng cho hành trình chinh phục kiến thức!
- Bước 2: Tiếp theo, hãy chọn lớp học, môn học mà bạn muốn luyện và khu vực bạn đang sống để Examon cung cấp đề thi phù hợp nhất với bạn.
- Bước 3: Lựa chọn đề thi và Bắt đầu luyện, Examon có hai chế độ: Luyện tập để bạn làm quen và Thi thử để kiểm tra năng lực. Hãy chọn một đề thi phù hợp và bắt đầu luyện!
- Bước 4: Khi làm bài, hãy tập trung và nghiêm túc như thể bạn đang ở trong phòng thi thật sự. Đây là cơ hội để rèn luyện sự tự tin và kỹ năng giải quyết vấn đề của bạn.
- Bước 5: Nhận điểm và Phân tích kết quả sau khi hoàn thành, bạn sẽ nhận được điểm số ngay lập tức cùng với lời giải chi tiết cho từng câu hỏi, giúp bạn hiểu rõ mình cần cải thiện ở đâu.
Tham khảo ngay bộ đề được biên soạn đặc biệt bám sát 99.9% đề tham khảo kỳ thi THPT năm 2024 của Examon ngay!