Dựa vào giá trị enthalpy tạo thành chuẩn của một số chất cho ở bảng dưới đây hãy tính giá trị \(\text\Delta_{\mathrm{r}} \mathrm{H}_{298}^{0}\) của các phản ứng sau :
\(4 \mathrm{NH}_{3}(\mathrm{~g})+3 \mathrm{O}_{2}(\mathrm{~g}) \xrightarrow{\mathrm{t}^{\circ}} 2 \mathrm{~N}_{2}(\mathrm{~g})+6 \mathrm{H}_{2} \mathrm{O}(\mathrm{g})\)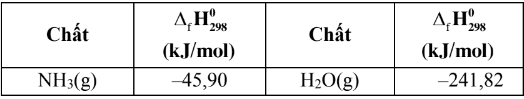
A.
\(-1276,32 \mathrm{~kJ}\)
B.
\(-1267,32 \mathrm{~kJ}\)
C.
\(+1276,32 \mathrm{~kJ}\)
D.
\(+1267,32 \mathrm{~kJ}\)
Giải thích:
\(\begin{aligned}\Delta_{r} H_{298}^{0} & =6 \Delta_{f} H_{298\left(N H_{3}\right)}^{0}-4 \Delta_{f} H_{298\left(N H_{3}\right)}^{0} \\& =6 .(-241,82)-4 .(-45,9)=-1267,32 \mathrm{~kJ}\end{aligned}\)
Câu hỏi này nằm trong: