Đốt cháy 13 gam một kim loại R (hoá trị II) trong bình chứa khí oxi có dư, sau phản ứng thu được 16,2 gam oxit RO. Xác định tên kim loại R.
Giải thích:
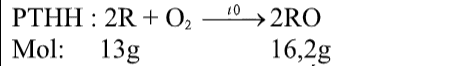
Theo định luật bảo toàn khối lượng, ta có:\(\mathrm{m}_{\text {khi oxi }}=\mathrm{m}_{\mathrm{Ro}}-\mathrm{m}_{\mathrm{R}}=16,2-13=3,2\) gam
Số mol của khí oxi tham gia phản ứng là:
\(\mathrm{n}_{\text {khi oxi }}=\frac{m}{M}=\frac{3,2}{32}=0,1(\mathrm{~mol})\)Theo \(\mathrm{PTHH}\), số mol của \(\mathrm{R}\) là: \(\mathrm{n}_{\mathrm{R}}=\frac{0,1.2}{1}=0,2(\mathrm{~mol})\)
Khối lượng mol của \(\mathrm{R}\) là: \(\mathrm{M}_{\mathrm{R}}=\frac{13}{0,2}=65(\mathrm{gam} / \mathrm{mol})\)
Vậy \(R\) là kim loại kẽm.
Câu hỏi này nằm trong: